单细胞转录组测序揭示衰老细胞的异质性
发布日期:2022-11-01 浏览次数:1556
自2009年单细胞转录组测序技术(scRNA-seq)问世以来,在过去的十年里,scRNA-seq技术得到了蓬勃的发展,从而使得可在单细胞水平揭示全基因组范围内所有基因的表达情况,可以更精准的开展细胞表达异质性研究、鉴定新的细胞亚型、描绘细胞发育路径、鉴定分子Marker等。目前,scRNA-seq已经被广泛应用于基础科研和临床研究。
在这里,给大家分享一篇2019年发表在Protein Cell(IF=10.164)期刊上的单细胞转录组测序文章。
研究背景
结果
| 1. 复制性细胞衰老的细胞异质性研究 |
为了研究复制性细胞衰老过程中异质性的变化,本研究中培养了HCA2成纤维细胞复制衰老,β-gal阳性细胞数量增加和EdU掺入率显著降低也证实了细胞衰老(图S1A)。然后,通过Drop-seq检测了1200个单细胞转录组,分别是群体倍增(PD)=38的年轻静止细胞,PD=48的中年静止细胞,PD=71的复制性衰老细胞(图1A)。在过滤低读取数和批处理效应校正的细胞后,对归一化程度高的可变基因进行了主成分分析(PCA)。而后使用基于图的聚类方法对细胞进行聚类,并通过t-分布式随机邻域嵌入(t-SNE)可视化细胞。
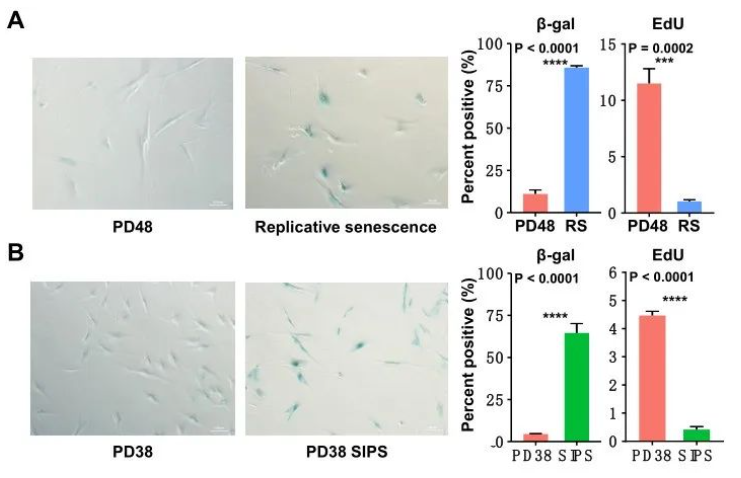
图S1.通过β-gal染色和EdU掺入试验确定衰老表型。
t-SNE分析将细胞分为5个不同的亚群(图1B)。图中展示了每个cluster中代表性的上调Marker基因,cluster1由静止细胞组成,主要富集核糖体相关基因,cluster2和cluster3表现出SASP基因、血管生成相关基因和凋亡相关基因的上调(图S2A)。cluster4由增殖细胞组成,主要富集细胞周期相关基因(例如,MKI67,TOP2A和CENPE,图S2B),因此在下游分析中排除了该cluster。此外,作者还将t-SNE图进行了比较,并用不同颜色代表不同细胞来反映原始样品来源(图1C)。尽管cluster0和cluster1均为静止细胞,但它们仍可以分为两个不同的cluster,每个cluster中的异质性均比较低。有趣的是,复制性衰老细胞被分为两个不同的亚群(图1C),因此表明在复制性衰老细胞中,细胞之间确实存在异质性。
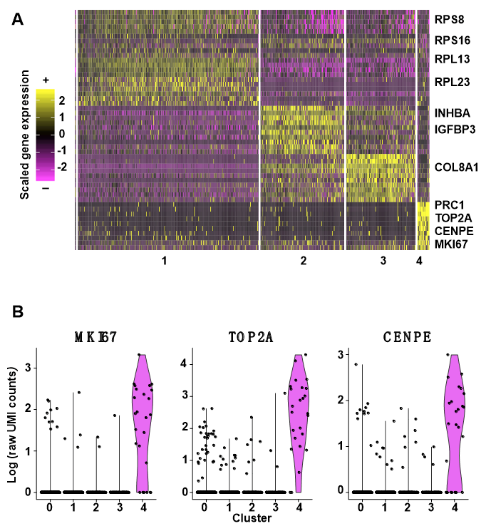
图S2.基于Droplet的scRNA-seq揭示了若干个Marker基因。
为了确定复制性细胞衰老过程中转录组水平的变化,作者使用cluster0作为对照,并分析了clusters之间的差异表达基因。应用Wilcoxon秩和检验法筛选差异表达基因,并用Bonferroni法校正多重比较。调整后的P<0.05和|log2fold change|>0.25设定为阈值进行差异表达基因的筛选。在复制性衰老细胞中,cluster3具有更多的上调基因和更少的下调基因(图S3A)。此外,在所有clusters中,甚至在静止和衰老细胞之间也存在共有的差异表达基因,并且cluster2中70%以上的差异表达基因与cluster3一致,但是,cluster3拥有比cluster2更多其特异性的差异表达基因(图S3B)。这些cluster3特异性的差异表达基因可能导致了复制性衰老细胞的异质性。

图S3.复制性衰老HCA2成纤维细胞的转录组变化。
为进一步研究不同clusters之间的差异,作者还对每个cluster的上调和下调基因进行了基因集富集分析(GSEA)以鉴定GO、KEGG、REACTOME相关的富集通路。与差异表达基因数目的差异一样,与cluster2相比,cluster3有更多的上调基因富集通路和更少的下调基因富集通路(图S3C)。此外,在cluster2和cluster3之间存在一些共有的富集通路,例如:上调基因富集通路(细胞周期阻滞、脂质代谢),下调基因富集通路(核糖体生物发生、蛋白质的翻译和代谢)。除了共有的富集通路,与cluster2相比,cluster3在上调基因中富集到更多与衰老相关途径,而在下调基因中富集到较少与衰老相关途径。许多cluster3的上调基因主要富集于血管生成、免疫系统、IL1信号传导、SASP产生和分泌、细胞凋亡和伤口愈合等通路。仅在cluster2上调基因中发现与衰老相关蛋白酶体通路的富集(图1D和S3D)。但是,在下调基因中,cluster1富集通路主要包括赖氨酸降解、碱基切除修复、RNA甲基化、端粒酶维持端粒,cluster2富集通路主要包括自噬调控、免疫应答、细胞凋亡、染色体组织、DNA修复(图S3D)。根据GSEA分析结果,作者推测一小部分的复制性衰老细胞起着不同于其他细胞的作用。这些细胞产生更多的SASP因子(尤其是TGF超家族),并激活IL-1信号通路诱导更多的SASP,进而通过旁分泌SASP信号传导促使邻近细胞衰老。SASP因子的过多分泌还与免疫应答增强有关,导致炎症并可能促进肿瘤发生。

图1.复制性衰老HCA2成纤维细胞的异质性和转录组谱的变化。
| 2. SIPS细胞异质性研究以及衰老核心特征基因的鉴定 |
下面,作者则继续揭示SIPS细胞异质性和转录组的潜在变化。使用Drop-seq对400个SIPS细胞进行转录组测序。以50Gy的剂量照射PD38的HCA2静止细胞,20天后通过β-gal染色和EdU掺入法确认了衰老表型(图S1B)。通过分析SIPS细胞的单细胞转录组,发现与复制性衰老细胞相比,SIPS细胞之间的异质性较低(图2A和2B),大多数SIPS细胞被集群到cluster1中。
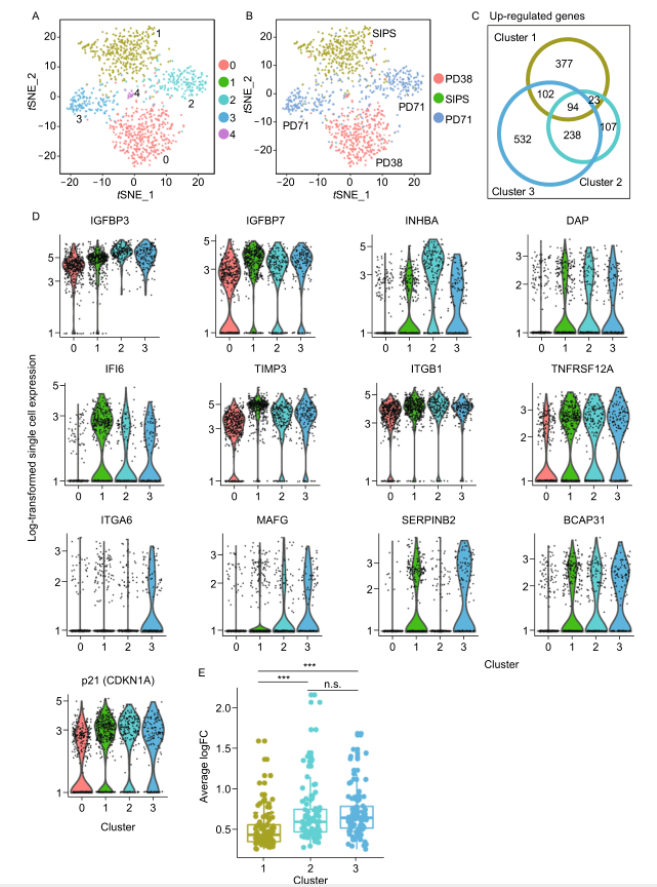
图2.SIPS对HCA2成纤维细胞异质性的影响。
有观点认为消除衰老细胞可以减轻衰老引起的身体机能障碍并延长寿命。因此,为了鉴定表征衰老特征并可以作为清除衰老细胞标志物的核心基因,作者依旧采用PD38静止细胞(cluster0)作为对照,并对每个cluster进行差异表达分析。衰老核心特征是由复制性衰老细胞和SIPS细胞clusters共有的上调基因定义的。衰老核心特征基因包含94个上调基因(图2C),包括经典的衰老标记(p21),SASP成员(IGFBP3、IGFBP7),凋亡过程参与(INHBA、DAP等),细胞因子反应(IFI6、TIMP3等),血管生成(ITGB1、TNFRSF12A),伤口反应(ITGA6、MAFG等)和蛋白水解调节(SERPINB2、BCAP31等)(图2D)。cluster2和cluster3的衰老核心特征基因的上调表达变化倍数显著高于cluster1。但是,cluster2和cluster3之间,衰老核心特征基因的平均倍数变化无显着差异(图2E)。作者还分析了端粒侵蚀与电离辐射诱导的衰老之间的转录组差异。通过比较在RS和SIPS状态下细胞的上调/下调基因富集通路,观察到较少的共有上调基因。RS细胞中上调基因主要富集于细胞因子产生、血管生成、IL1信号通路,而SIPS细胞中上调基因主要富集于VEGF和NOTCH1信号通路。SIPS细胞还与分子功能和催化活性的负调控有关(图S4A)。尽管,RS细胞和SIPS细胞存在若干个共有的下调基因富集通路,包括核糖体的生物发生、蛋白质的翻译和代谢,但是,RS细胞比SIPS细胞拥有更多的下调基因富集通路,主要包括炎症反应的负调控和氧化应激诱导的固有凋亡信号通路。RS细胞中的DNA修复和染色体组织通路也被下调(图S4B),这也与先前的报道是一致的。
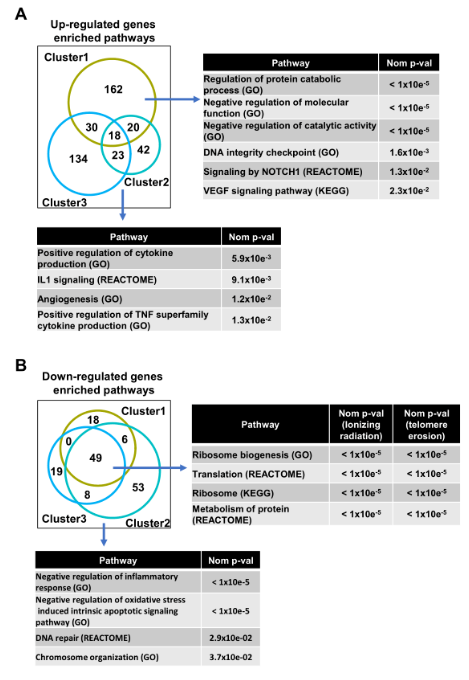
图S4.端粒侵蚀与电离辐射诱导的衰老之间的转录组差异。
结论
本研究证明了与静止细胞和电离辐射诱导的衰老细胞不同,复制性衰老细胞具有更高的异质性。一些复制性衰老细胞产生并分泌更多的SASP,这些SASP可以诱导旁分泌性衰老,从而导致肿瘤发生、血管生成和转移。实验方法和生物信息学方法相互佐证,共同鉴定衰老细胞特异性的标志物,这将增加我们对衰老生物学的理解,并为精确消除衰老细胞奠定基础。与复制性衰老细胞相比,SIPS细胞更为同质。作者提出,PD38亲本的年轻细胞与应力诱导的SIPS细胞具有较高的同质性是导致SIPS异质性较低的主要原因。然而,体内的情况十分复杂,因此体内SIPS细胞是否异质仍有待研究。
