Molecular Therapy | 低氧刺激诱导小鼠胚胎干细胞肌源性谱系分化
发布日期:2022-10-28 浏览次数:1910
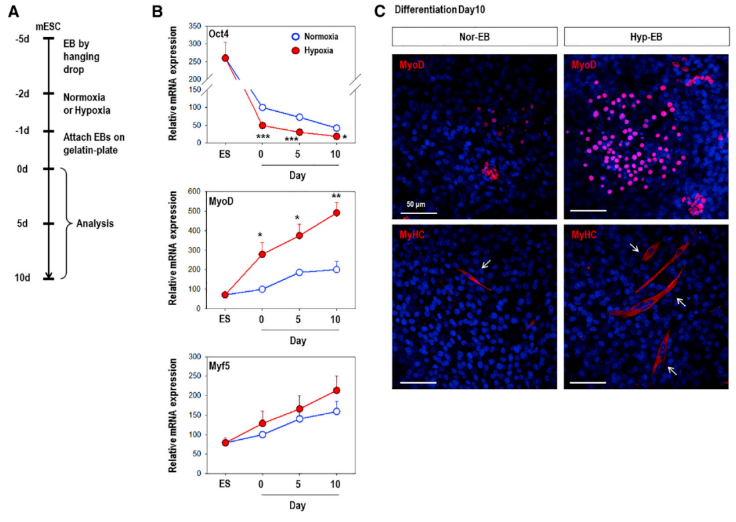
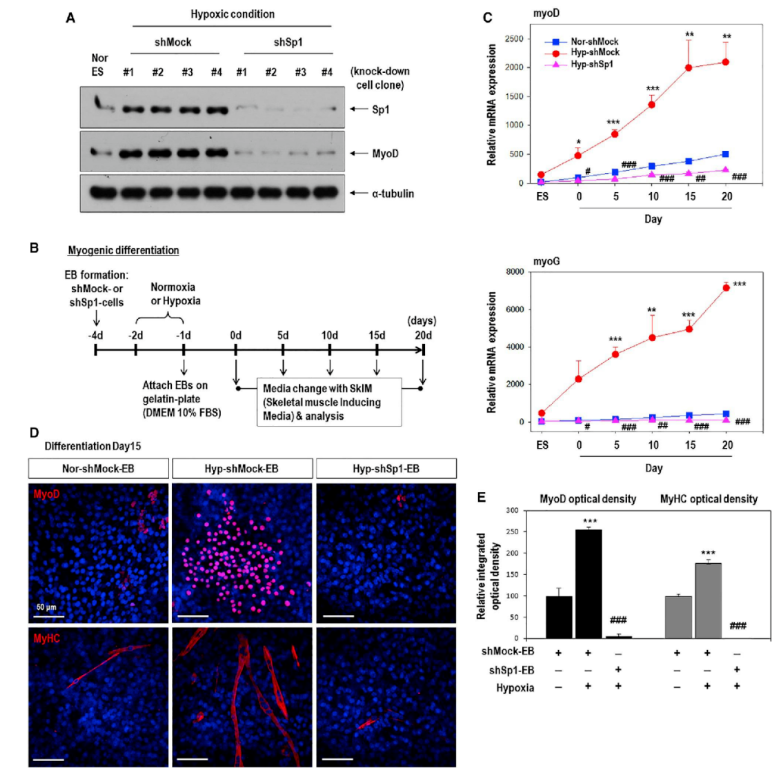
正常情况下,空气中氧气浓度为21%左右。而人类的生存离不开氧气,但是,适当的低氧微环境对人类的生长发育有着重要作用。在此,我们将为大家分享一篇发表在Molecular Therapy ( IF 8.986 )期刊的文章“The MicroRNA-92a/Sp1/MyoD Axis Regulates Hypoxic Stimulation of Myogenic Lineage Differentiation in Mouse Embryonic Stem Cells.”(miRNA-92a/Sp1/MyoD 调控低氧刺激下的小鼠胚胎干细胞肌源性谱系细胞分化)。一、低氧诱导小鼠胚胎干细胞(mESC)分化为肌源性细胞谱系低氧微环境存在于胚胎组织的发育过程中,并决定干细胞的命运。先前已经证明低氧刺激在胚胎干细胞的谱系分化中决定起着重要作用。本研究中,作者将mESC分别在常氧(21% O2)或低氧(1% O2)条件下培养,与常氧培养相比,低氧培养的mESC细胞中,多能性标记物Oct4基因mRNA的表达在各个时间点均明显降低,肌源性标记物MyoD、Myf5基因mRNA的表达在各个时间点均上调,其中MyoD上调表达更强烈。有趣的是,MyoD是主要的肌源性调节因子之一。免疫荧光检测也发现低氧刺激导致Hyp-EB中MyoD的强烈表达。因此,结果表明低氧刺激使得胚状体(Hyp-EBs)能有效地分化为肌源性谱系。 备注:细胞低氧培养条件(1% O2, 5% CO2, 94% N2)
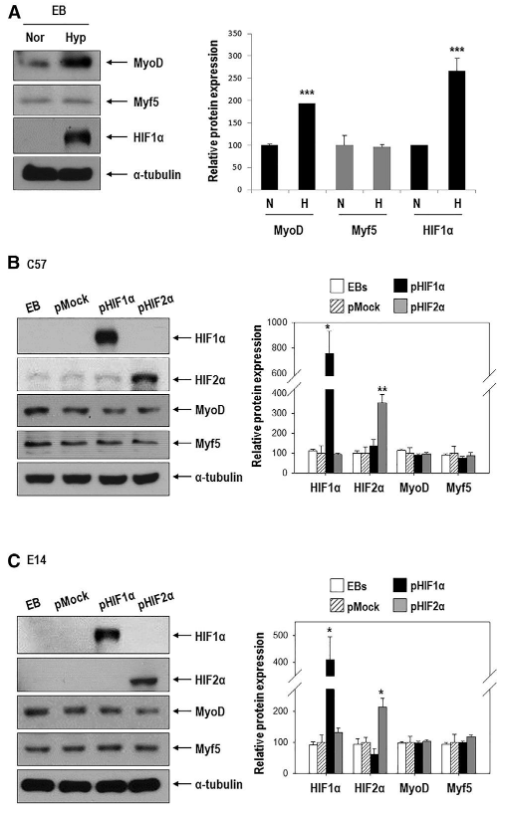
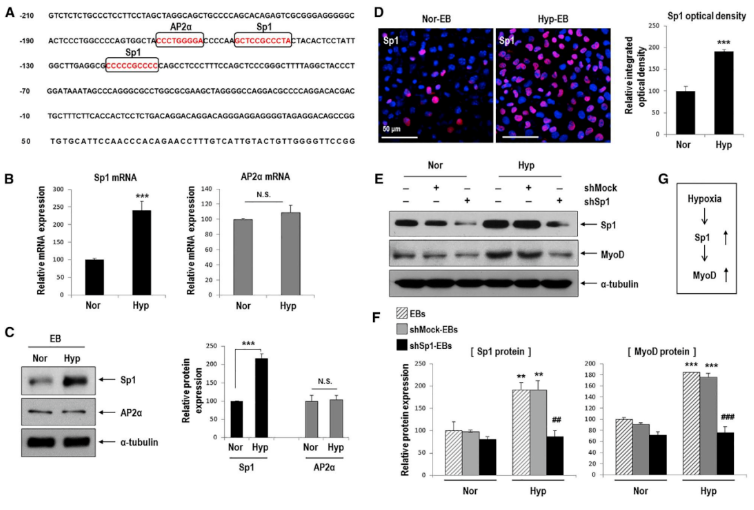
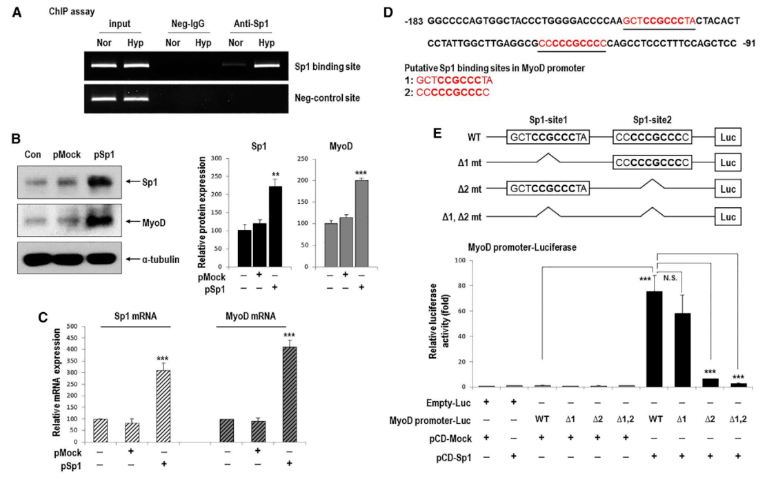
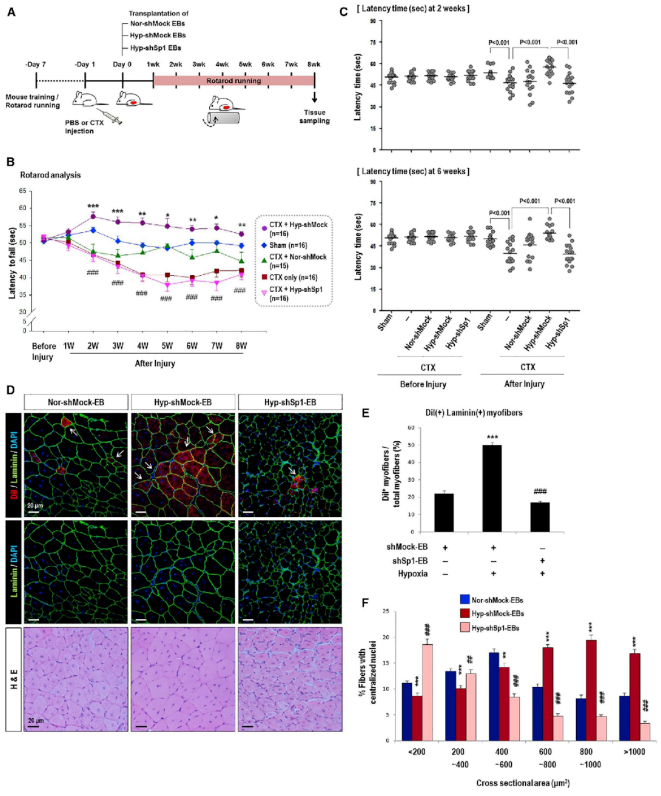
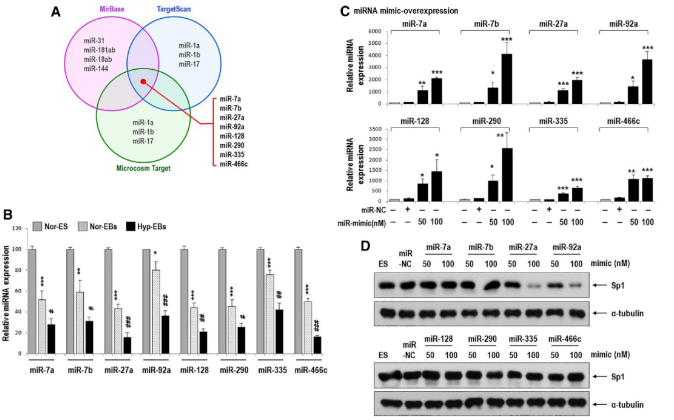
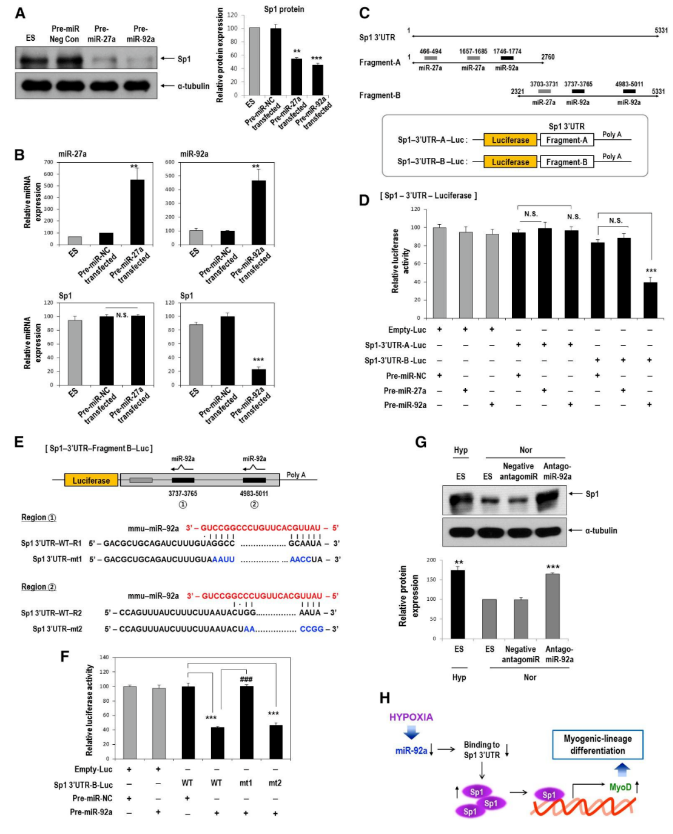
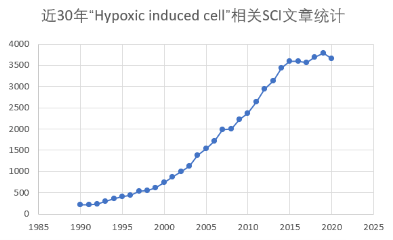
二、低氧刺激的MyoD表达上调是由Sp1介导,而不由HIF1或HIF2介导低氧刺激增强肌源性谱系分化的分子机制是怎样的呢?于是,作者重点关注MyoD(肌源性调节因子)和HIF(低氧诱导因子)。低氧条件下,MyoD和HIF1a蛋白表达均显著增强,而Myf5蛋白表达未发生变化。为进一步探究HIF1a或HIF2a对MyoD表达的影响,作者在常氧条件下用HIF1a或HIF2a表达载体转染细胞,推测MyoD的表达将受到HIF1a或HIF2a过表达的影响;然而,MyoD蛋白质和 mRNA表达均未受此影响。然后,作者分析了MyoD启动子区域,找到2个候选调节因子Sp1和AP2a,确定了1个AP2a结合位点和2个Sp1结合位点。与常氧相比,低氧时Hyp-EBs中Sp1基因的mRNA和蛋白质表达均发生上调,然而AP2a的mRNA和蛋白质表达均未受影响。免疫荧光结果也证实了Sp1在低氧时表达增强。接下来,为了确定Sp1对MyoD表达的影响,首先使用shRNA对Sp1基因进行敲减。在低氧条件下,Sp1蛋白和mRNA表达明显增加。但是,转染 shSp1后,即使在低氧条件下Sp1蛋白和mRNA表达也明显降低。有趣的是,低氧条件下MyoD蛋白和mRNA表达在shSp1-EBs中也显著下调。以上结果表明,MyoD的表达依赖于Sp1对低氧刺激的反应。三、Sp1通过激活MyoD启动子活性增强MyoD转录由于Sp1基因敲低抑制低氧介导的MyoD上调,于是接下来,作者对于Sp1激活MyoD启动子的能力进行检测。 首先,作者开展染色质免疫沉淀(ChIP)实验验证MyoD启动子序列中包含Sp1结合位点。ChIP实验表明,与常氧相比,低氧时Sp1与MyoD 启动子区的结合增强。此外,启动子荧光素酶报告检测结果也证明了这一点(文中未展示)。采用Sp1过表达载体转染C57 ESCs,也证明Sp1过表达可以促进MyoD转录和表达增强。 随后,将MyoD启动子序列中Sp1的结合位点点突变,分别构建WT、D1-mt(第一个Sp1结合位点Sp1-site1被删除)、D2-mt(第二个Sp1结合位点Sp1-site2被删除)、D1,2(两个Sp1结合位点都被删除)的过表达质粒。在Sp1过表达细胞中,转染WT-MyoD后发现荧光素酶活性显著增加;有趣的是,与转染WT-MyoD相比,转染D1-mt的细胞中荧光素酶活性略有降低;而转染D2-mt的细胞中Sp1显著抑制MyoD的荧光素酶报告活性;此外,转染D1,2-mt的细胞中则表现出最低的MyoD荧光素酶报告活性。这些结果表明:Sp1激活MyoD启动子的能力在很大程度上取决于Sp1结合位点2。总之,低氧刺激诱导了EBs中肌源性标记物MyoD的表达,且不由缺氧诱导因子1a(HIF1a)或 HIF2a介导,而是由Sp1结合于MyoD启动子来介导。四、Sp1介导的MyoD表达对低氧刺激EB分化为肌源性谱系具有至关重要的作用为进一步确定Sp1在调控肌源性谱系分化中的作用,对Sp1基因进行了敲低。转染shSP1后,Sp1 蛋白和mRNA表达均明显降低。之后分别对转染shMock或shSP1的4个克隆进行了MyoD表达验证,结果表明低氧刺激下Sp1敲低后,MyoD也显著降低。然后,为进一步分析shSP1-EBs在低氧反应中的特异性肌源性分化潜能,采用骨骼肌诱导培养基(SkIM)培养细胞进行细胞的肌肉分化实验。与对照NOR-shock-EBs相比,Hyp-shock-EBs分化过程中肌源性调节因子MyoD和 myogenin显著上调。相反地,Sp1基因敲低的EBs(shSp1)即使在低氧条件下也表现出肌源性分化受损现象。接下来,开展了MyoD和MyHC的免疫荧光实验,证明Sp1确实参与了低氧驱动的肌源性谱系分化。两种标记物在Hyp-shockEBs中均有较强的染色。相反地,MyoD和MyHC在Hyp-shSP1EBs中几乎检测不到,这表明Sp1是低氧反应中肌源性分化的重要调节因子。在体外,Hyp-EBs表现出有效的肌源性谱系分化能力,而且Sp1介导了低氧诱导的EB-肌源性谱系分化。为了测试低氧诱导EBs分化肌源性谱系并促进肌肉再生是否可以在体内进行,采用心肌毒素(CTX)诱导肌肉损伤小鼠模型,并采用rota-rod分析监测肌肉再生的时间过程。通过注射CTX诱导双腿胫前肌(TA)损伤,1天后分别移植常氧Nor-shMockEBs 、低氧Hyp-shockEBs、低氧Sp1基因敲除Hyp-shSP1EBs。每周记录小鼠从旋转杆上跌落的时间监测运动恢复情况,监测时间长达8周。与体外实验结果一致,CTX+Hyp-shMock小鼠表现出的运动功能明显优于CTX+Nor-shMock小鼠,这种治疗效果从损伤后2周开始,一直持续到8周(监测结束时)。有趣的是,CTX+Hyp-shSP1小鼠与CTX+Hyp-shMock小鼠相比,运动功能减弱。随后,在移植带有Dil标记(红色荧光)EBs的小鼠中观察到具有中央核的再生肌纤维,与Nor-shMock组相比,在Hyp-shMock组中再生肌纤维更多,而Hyp-shSP1组肌纤维明显减少。再生肌纤维的横截面积检测发现,Hyp-shMock组的肌纤维明显大于Nor-shMock组,而Hyp-shSP1组肌肉横截面积远小于Hyp-shMock组。这些结果表明Hyp-shMockEBs成功移植并分化为肌源性谱系,进而改善了rota-rod性能,然而,这一作用会被Sp1表达抑制而减弱。六、缺氧介导miRNA-92a表达抑制,进而促进Sp1表达上调前面已经明确Sp1会因低氧刺激而表达增强,于是接下来对Sp1上游的调控因子进行了探究,重点关注抑制靶基因表达的miRNAs。为了筛选出低氧刺激诱导的低表达miRNA,于是对常氧ESCs、常氧EBs和低氧EBs进行了miRNA microarray检测分析。在三组之间发生显著变化的有388个miRNAs。采用TargetScan, microRNA.org, miRBase预测靶基因sp1 3'UTR结合的miRNAs。最终筛选到8个候选基因,并且经实验验证,在缺氧EBs中均表现为下调表达。然后,分别采用每个miRNA的mimic转染细胞后,发现只有miR-27a和miR-92a可以明显抑制Sp1表达,而其他mimic的表达不影响Sp1的表达水平。接下来,分别过表达miR-27a和miR-92a 前体(pre-miR),均下调了Sp1蛋白的表达水平,此结果与转染mimic结果一致。但是,过表达miR-92a前体显著抑制了Sp1 mRNA表达,而过表达miR-27a前体未影响到Sp1 mRNA表达。依据以上结果,于是推断miR-27a在蛋白水平调控Sp1表达,而miR-92a在mRNA水平调控Sp1表达。然后,采用荧光素酶报告试验研究miR-27a和miR-92a 是否可以直接靶向Sp1 3'UTR。由于Sp1 3'UTR片段超过5kb,序列过长,因此需分成小片段构建到质粒中,其中A片段包含2个miR-27a结合位点和1个miR-92a结合位点,片段B包含1个miR-27a结合位点和2个miR-92a结合位点。分别过表达pre-miR-27a和pre-miR-92a 后,发现只有pre-miR-92a显著抑制了B片段载体中的荧光素酶活性,而pre-miR-27a未影响此载体中的荧光素酶活性。A片段载体中的荧光素酶活性均未受到pre-miR-27a或 pre-miR-92a的影响。在B片段中包含2个miR-92a结合位点(region1和region2),那么究竟哪一个结合位点才是真正起作用的呢?于是针对B片段中region1和region2分别进行点突变(mut)。结果发现,过表达pre-miR-92a显著抑制WT和region2-mut中的荧光素酶活性,相反地,过表达pre-miR-92a不影响region1-mut中的荧光素酶活性。以上结果表明:miR-92a直接靶向Sp1 3'UTR的region1。此外,在常氧条件下,转染miR-92a拮抗剂(antagomiR)可以抑制miR-92a表达(再现了低氧条件下miR-92a表达降低的效果),此时即使在常氧条件下Sp1的表达也会增加。以上结果充分地证明Sp1可能是miR-92a的直接靶点。在本研究中,作者发现低氧刺激胚状体(Hyp-EBs)能有效地分化为肌源性谱系,诱导肌源性标记物MyoD的表达,且不由低氧诱导因子1a(HIF1a)或 HIF2a介导,而是由Sp1诱导结合于MyoD启动子。敲减Hyp-EBs中Sp1可抑制低氧诱导的MyoD表达和肌源性分化。更重要的是,在心脏毒素-肌肉损伤小鼠模型中,移植Hyp-EBs促进体内肌肉再生,而移植Sp1敲除的Hyp-EBs却无此效果。此外,作者还比较了常氧和低氧条件下EBs之间的miRNA表达谱,发现低氧介导的Sp1诱导是通过抑制miRNA-92a介导的。此外,荧光素酶报告实验中通过对Sp1 3'UTR区结合位点的突变解除了miRNA-92a对Sp1的抑制作用。总之,以上结果表明,低氧刺激增强了miR-92a/Sp1/MyoD轴调控EB决定-肌源性谱系分化,揭示了一种促进肌源性谱系分化的新途径。因此,干细胞/祖细胞在移植前的低氧启动或药理学药物(如antagomiR-92a)调节Sp1的表达,可能是增强再生医学中肌肉修复的可行的新治疗策略。参考文献:LeeSY, et al. The MicroRNA-92a/Sp1/MyoDAxis Regulates Hypoxic Stimulation of Myogenic Lineage Differentiation in MouseEmbryonic Stem Cells. Mol Ther.2020, 28(1):142-156. doi:10.1016/j.ymthe.2019.08.014.氧分子(O2)是线粒体ATP和许多细胞内生化反应所必需的一种关键底物,因此其稳态的维持对于大多数物种生存至关重要。在O2出现匮乏的时候,哺乳动物细胞就会出现多种适应情况,比如低氧诱导因子HIF、mTOR、自噬、以及ER应激反应。近年来,低氧(Hypoxic)于生物机体及细胞的生理作用及其分子机制研究越来越受到科研人员的关注。附图说明近30年来与“低氧诱导”相关的文章统计(数据来源于Pubmed数据库)。
细胞是生物体结构和功能的基本单位,细胞缺氧是缺血缺氧性疾病发病机制的关键环节,所以建立细胞缺氧模型是从细胞水平及分子水平动态研究该类疾病的重要方法。目前,已经建立了许多细胞缺氧模型,为缺血缺氧性疾病的研究打下了坚实的基础。
正常情况下,细胞体外培养需5%CO2与95%空气环境,然而,降低培养环境的氧分压或使细胞用氧障碍可以造成缺氧状态,目前常用的缺氧方法有物理性缺氧法和化学性缺氧法。
物理性缺氧法 通过降低培养环境的氧分压造成细胞缺氧性损伤,类似于体内发生的低张性缺氧。
细胞缺氧培养系统
化学性缺氧法 在培养基中加入化学物质,造成细胞用氧障碍或使培养基内的氧气耗尽,如在培养基内加人氰化物、连二亚硫酸钠等。化学缺氧模型制备简单,但由于添加的物质可能会改变培养基的化学成分,且添加剂本身对细胞有损伤作用,增加了实验的混杂因素,需慎重选用。氰化物中的氰离子(CN- )可迅速与细胞内氧化型细胞色素氧化酶的三价铁结合形成氰化高铁细胞色素氧化酶,使之不能还原,电子传递中断,造成细胞用氧障碍;氰化物还阻断线粒体氧化磷酸化,抑制细胞色素C氧化酶,呼吸链中断,引起组织性缺氧。连二亚硫酸钠又称保险粉,为氧结合剂,可在短时间内结合液体培养基内的氧气,造成细胞低张性缺氧。还有用其他化学物质如氧化钴制作缺氧模型的。联合缺氧法 2种或2种以上方法联合使用可使细胞缺氧更为明显。例如:在培养基中添加连二亚硫酸钠,然后,将细胞放入95%N2+5%CO2密闭容器中,连二亚硫酸钠已使培养基内氧气耗尽,再置入无氧外环境即可造成稳定的细胞缺氧。
用于缺氧培养的细胞(举例)